Бевацизумаб — рекомбинантные гиперхимерные (гуманизированные, приближенные к человеческим) моноклональные IgG1 антитела, которые селективно связываются и ингибируют биологическую активность фактора роста эндотелия сосудов (VEGF) in vitro и in vivo. Бевацизумаб содержит человеческие каркасные участки с определяющими комплементарность участками гиперхимерного антитела мыши, которые связываются с VEGF. Бевацизумаб получают по технологии рекомбинантной ДНК в системе для экспрессии, представленной клетками яичников китайского хомячка.
Содержание
Русское название
Английское название
Bevacizumab.
Латинское название вещества Бевацизумаб
Bevacizumabum (род. Bevacizumabi).
Брутто формула
C6638H10160N1720O2108S44
Фармакологическая группа вещества Бевацизумаб
Противоопухолевые средства — моноклональные антитела.
Нозологическая классификация
- (C20) Злокачественное новообразование прямой кишки;
- (C19) Злокачественное новообразование ректосигмоидного соединения;
- (C18) Злокачественное новообразование ободочной кишки;
Код CAS
216974-75-3
Фармакологическое действие
Фармакологическое действие: Фармакологическое действие - противоопухолевое..
Характеристика
Бевацизумаб — рекомбинантные гиперхимерные (гуманизированные, приближенные к человеческим) моноклональные IgG1 антитела, которые селективно связываются и ингибируют биологическую активность фактора роста эндотелия сосудов (VEGF) in vitro и in vivo. Бевацизумаб содержит человеческие каркасные участки с определяющими комплементарность участками гиперхимерного антитела мыши, которые связываются с VEGF. Бевацизумаб получают по технологии рекомбинантной ДНК в системе для экспрессии, представленной клетками яичников китайского хомячка.
Фармакология
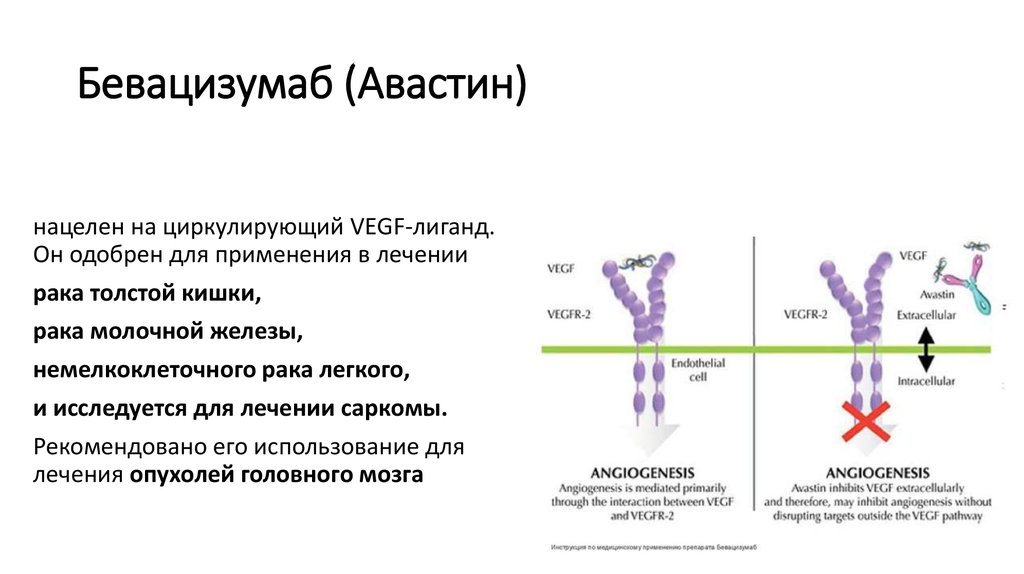
Связывается с VEGF и предотвращает взаимодействие VEGF с его рецепторами (Flt-1 и KDR) на поверхности эндотелиальных клеток. Взаимодействие VEGF с его рецепторами приводит к пролиферации эндотелиальных клеток и образованию новых кровеносных сосудов на моделях ангиогенеза in vitro. Введение бевацизумаба на моделях ксенотрансплантата раковой опухоли прямой кишки у мышей с мутацией nu (главные проявления мутации nu — отсутствие тимуса и шерстяного покрова) приводит к снижению васкуляризации и угнетению роста опухоли.
При в/в введении бевацизумаба в диапазоне доз от 1 до 10 мг/кг в течение 90 мин его фармакокинетика была линейной. При введении бевацизумаба 1 раз в неделю каждые 2 нед, или каждые 3 нед в дозах от 1 до 10 мг/кг объем распределения составил 2,66 и 3,25 л у женщин и мужчин соответственно. После однократного в/в введения 125I-бевацизумаба его метаболические характеристики были аналогичны характеристикам природной молекулы IgG1. Клиренс бевацизумаба варьирует в зависимости от массы тела, пола и опухолевой нагрузки. После коррекции дозы с учетом массы тела клиренс бевацизумаба составлял 0,207 л/сут у женщин и 0,262 л/сут у мужчин. Объем распределения и клиренс соответствуют начальному T1/2 — 1,4 дня и конечному T1/2 — 20 и 19 дней у женщин и мужчин соответственно. Этот T1/2 аналогичен конечному T1/2 человеческого эндогенного IgG1, который составляет 18–23 дня. У пациентов с низким содержанием альбумина (≤29 г/дл) и высоким уровнем ЩФ (≥484 ЕД/л) (оба показателя являются маркерами тяжести заболевания) клиренс бевацизумаба примерно на 20% выше, чем у пациентов со средними значениями лабораторных показателей.
Не выявлено значимых различий фармакокинетики бевацизумаба в зависимости от возраста.
Данных по оценке канцерогенного действия бевацизумаба у животных и человека нет.
Бевацизумаб может влиять на фертильность. Дозозависимое снижение массы яичников и матки, пролиферация эндометрия, изменение менструального цикла, задержка развития фолликулов и отсутствие прогестерона отмечались у самок обезьян cynomolgus при введении бевацизумаба в дозах 10 или 50 мг/кг в течение 13 или 26 нед.
Введение бевацизумаба приводит к подавлению метастатического прогрессирования заболевания и снижению микрососудистой проницаемости при различных опухолях человека, включая рак ободочной кишки, молочной железы, поджелудочной железы и предстательной железы.
Бевацизумаб в комбинации с иринотеканом, фторурацилом и кальция фолинатом (Лейковорином) (ИФЛ) в качестве первой линии терапии у больных с метастатическим колоректальным раком (мКРР) статистически значимо увеличивает общий период выживания с 15,6 до 20,3 мес (р=0,00004) во всех подгруппах пациентов независимо от возраста, пола, общего состояния, локализации первичной опухоли, количества пораженных органов и продолжительности метастатического заболевания. Добавление бевацизумаба к химиотерапии ИФЛ увеличивает период выживания без прогрессирования заболевания с 6,2 до 10,6 мес (р<0,00001), общую частоту ответа на лечение с 34,8 до 44,8% (р=0,0036) и медиану продолжительности ответа на лечение с 7,1 до 10,4 мес.
Более низкий риск смертности отмечен в группе, получавшей бевацизумаб в комбинации с ИФЛ по сравнению с группой, получавшей только химиотерапию ИФЛ.
При назначении бевацизумаба (5 мг/кг, каждые 2 нед) в комбинации с фторурацилом/лейковорином в качестве первой линии терапии у больных с мКРР и наличием противопоказаний для терапии иринотеканом (возраст старше 65 лет, предшествующая лучевая терапия брюшной полости и таза) или с меньшей вероятностью получения преимущества от терапии иринотеканом (исходный уровень альбумина <3,5 г/дл) отмечены более высокий объективный ответ на лечение — 40% по сравнению с 15,2–16,7% без бевацизумаба, значимое увеличение периода выживания без прогрессирования (с 5,2 до 9,2 мес) и тенденция к увеличению периода выживания (с 13,6 до 17,7 мес) по сравнению с назначением только химиотерапии фторурацилом/ лейковорином.
Применение вещества Бевацизумаб
Метастатический колоректальный рак: в качестве терапии первой линии в комбинации с химиотерапией на основе производных фторпиримидина.
Применение при беременности и кормлении грудью
Исследования на животных (кролики) показали, что бевацизумаб в дозах, близких к дозам для человека (при пересчете на мг/кг), проявлял тератогенное действие. Наблюдаемые эффекты включали: снижение массы тела плодов и самок, увеличение числа фетальных резорбций, повышение частоты специфических и скелетных повреждений плода. Побочные эффекты у плодов наблюдались при всех тестируемых дозах.
Ангиогенез является важным этапом развития плода и ингибирование ангиогенеза вследствие введения бевацизумаба проявляется неблагоприятным влиянием на беременность.
Применение бевацизумаба у беременных женщин и женщин, не использующих адекватных мер контрацепции, возможно, если ожидаемый эффект терапии превышает потенциальный риск для плода. Адекватных и строго контролируемых исследований у беременных женщин не проведено.
Пациенты, прекратившие лечение бевацизумабом, должны быть проинструктированы о его пролонгированном воздействии после окончания терапии (T1/2 примерно 20 дней) и возможном воздействии на развитие плода. Мужчинам и женщинам детородного возраста во время лечения бевацизумабом и как минимум в течение 6 мес после окончания лечения необходимо использовать надежные методы контрацепции.
Категория действия на плод по FDA — C.
Неизвестно, экскретируется ли бевацизумаб в грудное молоко женщин. Поскольку человеческие IgG1 секретируются в грудное молоко, потенциально возможна абсорбция и неблагоприятное влияние на плод после инъекции. Вскармливание грудным молоком не рекомендуется как минимум в течение 6 мес после окончания терапии бевацизумабом.
Ограничения к применению
Артериальная гипертензия, артериальная тромбоэмболия в анамнезе, возраст старше 65 лет; при заживлении ран, кровотечениях, перфорации ЖКТ.
Противопоказания
Гиперчувствительность, метастазы в ЦНС, почечная и/или печеночная недостаточность, детский возраст (безопасность и эффективность у детей и подростков, а также у пациентов с почечной и/или печеночной недостаточностью не изучалась).
Побочные действия вещества Бевацизумаб
Наиболее серьезные побочные эффекты, наблюдавшиеся у пациентов, получавших бевацизумаб: перфорация ЖКТ, трудности при заживлении ран, кровоизлияние, артериальная тромбоэмболия, гипертензивный криз, обратимый лейкоэнцефалопатический синдром, нейтропения и инфекция, нефротический синдром, застойная сердечная недостаточность (см. «Меры предосторожности»).
У пациентов, получавших бевацизумаб, наиболее часто наблюдались: астения, боль различной локализации, в т.ч. абдоминальная, головная боль, артериальная гипертензия, диарея, тошнота, рвота, анорексия, стоматит, запор, инфекции верхних дыхательных путей, носовое кровотечение, диспноэ, эксфолиативный дерматит, протеинурия.
Представленные ниже данные получены при лечении бевацизумабом 1529 пациентов, включая 665 больных, получавших его в течение по крайней мере 6 мес, и 199 пациентов, получавших его в течение по крайней мере 1 года. Исследования бевацизумаба проводились в плацебо- и актив-контролируемых испытаниях (n=501 и n=1028 соответственно).
Перфорация ЖКТ. Частота случаев перфорации ЖКТ в исследованиях составляла 0–3,7%. Частота перфорации ЖКТ, в некоторых случаях фатальной, у пациентов с мКРР при терапии бевацизумабом или бевацизумабом в комбинации с химиотерапией составляла 2,4% в сравнении с 0,3% у пациентов, получавших только химиотерапию.
Трудности при заживлении ран. Частота постоперационных осложнений и/или кровотечения была выше у пациентов с мКРР при терапии бевацизумабом в сравнении с пациентами, получавшими химиотерапию.
Кровоизлияния. Тяжелые или фатальные кровоизлияния, в т.ч. кровохарканье, кровотечение в ЖКТ, гематемезис, кровоизлияние в ЦНС, носовое кровотечение, вагинальное кровотечение — встречались в 5 раз чаще у больных, получавших бевацизумаб, чем у пациентов, получавших только химиотерапию.
Геморрагические осложнения 3–5 степени, в соответствии с общими критериями токсичности Национального института рака США (National Cancer Institute Common Toxicity Criteria — NCI–CTC), наблюдались у 4,7% пациентов с немелкоклеточным раком легкого (НМРЛ) и у 5,2% больных с мКРР, получавшими бевацизумаб, в сравнении с 1,1% и 0,7% в контрольных группах.
Частота носового кровотечения была выше (35% против 10%) у пациентов, получавших бевацизумаб в комбинации с ИФЛ, в сравнении с пациентами, получавшими только химиотерапию ИФЛ и плацебо. Эти кровотечения были легкой или средневыраженной тяжести (степень 1) и проходили без медицинского вмешательства. Кроме того, также легко- или средневыраженными были желудочно-кишечные геморрагии (24% против 6%), кровотечение из десен (2/0%) и вагинальное кровотечение (4/2%).
Артериальная тромбоэмболия наблюдалась в 3% случаев у пациентов с НМРЛ при комбинированной терапии карбоплатин+бевацизумаб (3,0%) в сравнении с пациентами, получавшими только карбоплатин (1,4%). Пять летальных исходов было в группе больных, получавших карбоплатин+бевацизумаб, и один — в группе больных, получавших только карбоплатин. Эти данные о повышенном риске артериальной тромбоэмболии при лечении бевацизумабом больных с НМРЛ согласуются с данными при лечении больных с мКРР.
Венозная тромбоэмболия. Частота венозных тромбоэмболических осложнений 3–4 степени (в соответствии с NCI–CTC) была выше у пациентов с мКРР и НМРЛ при терапии бевацизумабом в сочетании с химиотерапией, чем у пациентов, получавших только химиотерапию. Кроме того, у больных с мКРР риск развития вторичных тромбоэмболических осложнений также был повышен у пациентов, получающих бевацизумаб и химиотерапию.
Артериальная гипертензия. У пациентов с мКРР, получавших бевацизумаб, наблюдалась повышенная частота возникновения артериальной гипертензии (АД>150/100 мм рт. ст.), в т.ч. выраженной гипертензии (АД>200/110 мм рт. ст.), по сравнению с пациентами, получавшими только химиотерапию. Среди пациентов с выраженной гипертензией у 51% значения дАД, превышающие 110 мм рт. ст., были ассоциированы со значениями сАД менее 200 мм рт. ст. Частота гипертензии 3 и 4 степени (в соответствии с NCI-CTC) на протяжении всех клинических исследований бевацизумаба составляла 8–18%.
Нейтропения и инфекция. В группе пациентов, получавших бевацизумаб в комбинации с ИФЛ, по сравнению с группой больных, получавших только химиотерапию ИФЛ, частота развития нейтропении была выше. Так, в исследовании у пациентов с мКРР частота нейтропении 3 и 4 степени (в соответствии с NC–CTC) составляла 21% у пациентов, получавших бевацизумаб в комбинации с ИФЛ, тогда как при химиотерапии ИФЛ — 14%. В исследовании у пациентов с НМРЛ частота нейтропении 4 степени у пациентов, получавших карбоплатин+бевацизумаб, равнялась 26,2%, у пациентов, получавших только карбоплатин — 17,2%; частота фебрильной нейтропении также была повышена в группе, получавшей карбоплатин+бевацизумаб (5,4% против 1,8%). Было зафиксировано 19 случаев (4,5%) нейтропенической инфекции при нейтропении 3 и 4 степени на фоне терапии карбоплатин+бевацизумаб, три из которых оказались летальными (при терапии только карбоплатином — 9 случаев (2%), летальных исходов не было). В период первых 6 циклов лечения частота серьезных инфекций, включая такие, как пневмония, фебрильная нейтропения, связанные с катетеризацией инфекции, была выше у пациентов, получавших карбоплатин+бевацизумаб: эти инфекции были отмечены у 58 пациентов (13,6%), в то время как в группе пациентов, получавших карбоплатин, было отмечено 29 случаев (6,6%).
Обратимый лейкоэнцефалопатический синдром отмечался в клинических исследованиях с частотой <0,1%, а также в постмаркетинговых исследованиях. Возможны неврологические нарушения (в т.ч. головная боль, припадки, летаргия, спутанность сознания, слепота, другие нарушения зрения), гипертензия средней или тяжелой степени выраженности. Для подтверждения наличия лейкоэнцефалопатического синдрома необходимо МРТ-исследование. Начало развития симптоматики лейкоэнцефалопатического синдрома отмечалось в период от 16 ч до 1 года после начала терапии бевацизумабом. В случае развития этого синдрома терапию бевацизумабом необходимо прекратить и инициировать коррекцию гипертензии (если она присутствует). Симптомы обычно разрешаются в течение нескольких дней, хотя у некоторых пациентов возможны последствия.
Протеинурия. Частота и выраженность протеинурии были повышены у пациентов, получавших бевацизумаб, по сравнению с контролем. Протеинурия 3 и 4 степени в соответствии с NCI–CTC (>3,5 г/сут) на фоне бевацизумаба составляла до 3%.
В ходе клинических исследований нефротический синдром был отмечен у семи из 1459 пациентов (0,5%). Один пациент скончался, одному потребовался диализ. У трех пациентов выраженность протеинурии уменьшилась через несколько месяцев после отмены бевацизумаба. Ни у одного из этих пациентов после прекращения терапии бевацизумабом суточный уровень выделения белка с мочой не нормализовался.
Безопасность продолжения лечения бевацизумабом у пациентов со средне- и сильновыраженной протеинурией не оценивалась. В большинстве клинических исследований терапия бевацизумабом была прекращена при уровне белка ≥2 г/сут и возобновлена при протеинурии <2 г/сут.
Фатальные нежелательные явления были зарегистрированы у 2,8% пациентов, получавших только химиотерапию ИФЛ, и у 2,6% пациентов, получавших бевацизумаб в комбинации с ИФЛ. Нежелательные явления, которые привели к отмене лечения, были зарегистрированы у 7,1% пациентов, получающих химиотерапию ИФЛ и у 8,7% пациентов, получающих комбинированную терапию бевацизумабом и ИФЛ.
В исследовании у пациентов с метастатической карциномой толстой и прямой кишки клинически значимая токсичность (в соответствии с NCI–CTC) 3 или 4 степени наблюдалась у 74% пациентов из группы ИФЛ (n=396) и у 87% пациентов из группы, получавшей бевацизумаб в комбинации с ИФЛ (n=392).
Побочные реакции любой степени тяжести, встречавшиеся у пациентов, получавших бевацизумаб в комбинации с ИФЛ или 5-фторурацилом/лейковорином включали следующие (в скобках указана частота побочных эффектов 3 и 4 степени — тяжелых и жизнеугрожающих, которые наблюдались в ≥2% случаев при терапии бевацизумабом в комбинации с ИФЛ):
Со стороны сердечно-сосудистой системы и крови (кроветворение, гемостаз): артериальная гипертензия (12%), артериальная гипотензия, тромбоз глубоких вен (9%), интраабдоминальные тромботические осложнения (3%), артериальная тромбоэмболия (включая инфаркт миокарда, инсульт, транзиторную ишемическую атаку и другие артериальные эмболии), хроническая сердечная недостаточность, лейкопения (7%), нейтропения (21%), тромбоцитопения, анемия.
Со стороны органов ЖКТ: диарея (34%), запор (4%), боль в животе (8%), рвота, анорексия, стоматит, диспепсия, перфорация ЖКТ, снижение массы тела, сухость во рту, колит, ректальное кровотечение, кровоточивость десен.
Со стороны респираторной системы: инфекции верхних дыхательных путей, носовое кровотечение, одышка, изменение голоса, ринит.
Со стороны кожных покровов: алопеция, сухость кожи, эксфолиативный дерматит, изменение цвета кожи.
Со стороны нервной системы и органов чувств: головная боль, головокружение, ишемия сосудов головного мозга, нарушение зрительной функции, извращение вкуса.
Прочие: астения (10%), боль (8%), синкопе (3%), абсцесс, сепсис, повышение температуры тела, вагинальное кровотечение; местные реакции (боль в месте введения).
Нарушения со стороны лабораторных показателей: нарушения лабораторных показателей 3 и 4 степени, наблюдавшиеся у пациентов, получавших бевацизумаб с или без химиотерапии — протеинурия, гипокалиемия, гиперкалиемия, гипонатриемия, гипофосфатемия, гипергликемия и увеличение уровня ЩФ крови.
Взаимодействие
Исследования лекарственного взаимодействия с другими противоопухолевыми средствами не проводились. У пациентов с мКРР, получавших бевацизумаб в комбинации с ИФЛ, отмечено увеличение концентрации активного метаболита иринотекана SN38 на 33%, по сравнению с пациентами, получавшими только ИФЛ (связь увеличения уровня SN38 с приемом бевацизумаба не установлена). У пациентов, получавших лечение ИФЛ+бевацизумаб, отмечено увеличение частоты таких нежелательных явлений, как диарея и лейкопения (известные нежелательные лекарственные реакции иринотекана), а также более частое снижение дозы иринотекана. При развитии тяжелой диареи, лейкопении или нейтропении во время комбинированной терапии бевацизумабом и иринотеканом, необходима коррекция дозы иринотекана.
Существующие данные позволяют предположить, что бевацизумаб не влияет на фармакокинетику фторурацила, карбоплатина, паклитаксела и доксорубицина.
При сочетанном применении варфарина (лечение венозных тромбозов) и бевацизумаба увеличения частоты серьезных кровотечений не отмечено.
Фармацевтически несовместим с растворами декстрозы.
Передозировка
Симптомы: усиление побочных эффектов. При назначении бевацизумаба в максимальной дозе 20 мг/кг в/в у нескольких пациентов отмечена мигрень тяжелой степени выраженности. Специфический антидот неизвестен.
Лечение: симптоматическое.
Меры предосторожности
Лечение бевацизумабом можно проводить только под наблюдением врача, имеющего опыт применения противоопухолевой терапии.
Перфорация ЖКТ. У пациентов с метастатическим раком ободочной или прямой кишки при лечении бевацизумабом в комбинации с химиотерапией существует повышенный риск развития перфорации ЖКТ. Наблюдались тяжелые случаи перфорации ЖКТ с внутрибрюшным воспалением, в т.ч. и фатальные. Несмотря на то что причинная связь внутрибрюшного воспаления, возникавшего в результате язвы желудка, некроза опухоли, дивертикула или колита, с приемом бевацизумаба не установлена, необходимо проявлять осторожность при лечении бевацизумабом пациентов с признаками внутрибрюшного воспаления. При развитии перфорации лечение бевацизумабом следует прекратить.
Трудности при заживлении ран. Бевацизумаб может отрицательно влиять на заживление ран. Лечение бевацизумабом не следует начинать в течение не менее 28 дней после хирургического вмешательства или до полного заживления хирургической раны. При развитии во время лечения осложнений, связанных с заживлением раны, бевацизумаб необходимо временно отменить до полного заживления раны. Прием бевацизумаба также необходимо временно прекратить в случае проведения факультативного хирургического вмешательства.
Кровотечения. У пациентов с мКРР повышен риск возникновения кровотечения, связанного с опухолью. Если во время лечения возникло кровотечение 3 или 4 степени тяжести, бевацизумаб следует отменить.
У пациентов с врожденным геморрагическим диатезом, приобретенной коагулопатией или получавших полную дозу антикоагулянтов по поводу тромбоэмболии, перед назначением бевацизумаба следует соблюдать осторожность.
У пациентов с НМРЛ (при плоскоклеточном раке или центральном расположении опухоли близко прилежащей к большим кровеносным сосудам), получавших бевацизумаб, зарегистрировано 6 серьезных кровотечений, 4 из которых были летальными. Кровотечение возникало внезапно и протекало по типу массивного кровохарканья. В пяти случаях ему предшествовало образование каверны и/или некроза опухоли. Редко наблюдались кровотечения и при других типах опухолей (гепатома с метастатическим поражением ЦНС, саркома бедра с некрозом).
Артериальная тромбоэмболия в анамнезе или возраст старше 65 лет ассоциируются с повышенным риском возникновения артериальной тромбоэмболии во время лечения бевацизумабом. При лечении таких пациентов необходимо проявлять осторожность. При возникновении артериальной тромбоэмболии терапию бевацизумабом необходимо прекратить.
Артериальная гипертензия. У пациентов, получавших бевацизумаб, наблюдалась повышенная частота возникновения артериальной гипертензии. Клинические данные по безопасности позволяют предположить, что частота случаев артериальной гипертензии не зависит от дозы бевацизумаба. Нет информации о влиянии бевацизумаба во время начала лечения у пациентов с неконтролируемой артериальной гипертензией. При назначении бевацизумаба таким пациентам необходимо проявлять осторожность и постоянно контролировать АД.
У пациентов с артериальной гипертензией, требующей лекарственной терапии, рекомендуется временно прекратить терапию бевацизумабом до достижения адекватного контроля АД. Если не удается установить медикаментозный контроль АД и/или при развитии гипертонического криза прием бевацизумаба необходимо прекратить.
Протеинурия. Риск развития протеинурии повышен у пациентов с артериальной гипертензией в анамнезе. Возможно, что протеинурия 1 степени зависит от дозы бевацизумаба. До начала и во время терапии бевацизумабом рекомендуется проводить анализ мочи на протеинурию. При развитии протеинурии 4 степени (нефротический синдром) бевацизумаб необходимо отменить.
Терапия антрациклинами и/или лучевая терапия на область грудой клетки в анамнезе могут способствовать развитию застойной сердечной недостаточности. У пациентов с такими факторами риска необходимо проявлять осторожность при назначении бевацизумаба.
При назначении бевацизумаба пациентам старше 65 лет существует повышенный риск возникновения артериальной тромбоэмболии (включая развитие инсульта, транзиторной ишемической атаки, инфаркта миокарда) и лейкопении. Повышения частоты других побочных явлений, включая перфорацию ЖКТ, нарушение заживления ран, артериальную гипертензию, протеинурию, кровотечение и застойную сердечную недостаточность, связанных с применением бевацизумаба у пожилых пациентов, не отмечено.
Способ применения и дозы
Только в/в капельно; вводить препарат в/в струйно нельзя!
Стандартный режим дозирования: 5 мг/кг, в виде в/в инфузии, длительно, один раз каждые 14 дней. Начальную дозу вводят в течение 90 мин после химиотерапии, последующие дозы можно вводить до или после химиотерапии. При хорошей переносимости первой инфузии, второе введение можно проводить в течение 60 мин, все последующие инфузии можно проводить в течение 30 мин при условии хорошей переносимости второй инфузии.
Не рекомендуется снижать дозу бевацизумаба из-за нежелательных явлений. В случае необходимости лечение бевацизумабом следует полностью или временно прекратить.