Содержание
Русское название
Английское название
Tofacitinib.
Латинское название вещества Тофацитиниб
Tofacitinibum (род. Tofacitinibi).
Химическое название
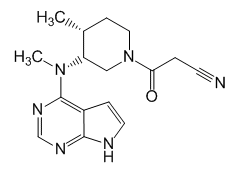
3-[(3R,4R)-4-метил-3-[метил(7H-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил]-3-оксопропанитрил (в виде цитрата).
Брутто формула
C16H20N6O
Фармакологическая группа вещества Тофацитиниб
Иммунодепрессанты.
Нозологическая классификация
- (M06.8) Другие уточненные ревматоидные артриты;
- (M06.9) Ревматоидный артрит неуточненный;
Код CAS
477600-75-2
Фармакологическое действие
Фармакологическое действие: иммунодепрессивное.
Характеристика
Лечение тофацитинибом сопровождается дозозависимым снижением циркулирующих натуральных киллеров CD16/56+. Расчетное максимальное снижение достигается по прошествии около 8–10 нед после начала терапии. Описанные изменения обычно разрешаются спустя 2–6 нед после окончания терапии.Фармакология
Тофацитиниб ингибирует JAK1, -2, -3 и в меньшей степени — тирозинкиназу 2. В тех клетках, где JAK передают сигнал парами, тофацитиниб предпочтительно ингибирует передачу сигнала гетеродимерных рецепторов, связанных с JAK3 и/или JAK1, обладая функциональной селективностью в отношении рецепторов, которые передают сигналы через пары JAK2. Ингибирование JAK1 и JAK3 под действием тофацитиниба блокирует передачу сигнала посредством общих рецепторов, содержащих гамма-цепи, в отношении нескольких цитокинов, включая ИЛ-2, -4, -7, -9, -15 и -21. Эти цитокины выполняют интегрирующую роль в процессах активации и пролиферации лимфоцитов, их функционирования и торможения передачи сигнала, что приводит к модулированию разнообразных аспектов иммунного ответа. Кроме того, ингибирование JAK1 приводит к ослаблению передачи сигнала под действием дополнительных провоспалительных цитокинов, таких как ИЛ-6 и гамма-интерферон. При более высокой экспозиции тофацитиниба ингибирование передачи сигнала JAK2 приводит к ингибированию передачи сигнала эритропоэтина.
Лечение тофацитинибом сопровождается дозозависимым снижением циркулирующих натуральных киллеров CD16/56+. Расчетное максимальное снижение достигается по прошествии около 8–10 нед после начала терапии. Описанные изменения обычно разрешаются спустя 2–6 нед после окончания терапии. Лечение тофацитинибом сопровождалось дозозависимым повышением количества В-клеток. Изменения количества циркулирующих Т-лимфоцитов и их субпопуляций были незначительными и непостоянными. Клиническое значение этих изменений неизвестно. Изменение общего сывороточного уровня IgG, -М и -А на протяжении 6-месячного периода лечения пациентов с ревматоидным артритом было небольшим, независимым от дозы и сходным с таковым при применении плацебо.
После лечения тофацитинибом пациентов с ревматоидным артритом отмечалось быстрое снижение сывороточного С-реактивного белка (С-РБ), что сохранялось на протяжении всего периода лечения. Изменения уровня С-РБ, отмеченные при лечении тофацитинибом, не проходили в течение 2 нед после отмены терапии, что свидетельствует о большей продолжительности фармакодинамичеекой активности по сравнению с T1/2.
Профиль фармакокинетики тофацитиниба характеризуется быстрым всасыванием (Cmax достигается в течение 0,5–1 ч), быстрым выведением (T1/2 около 3 ч) и пропорциональным дозе увеличением системной экспозиции. CSS достигается в течение 24–48 ч с незначительным накоплением после приема 2 раза в день.
Абсорбция и распределение. Тофацитиниб хорошо всасывается, биодоступность его составляет 74%.
Применение тофацитиниба с пищей, богатой жирами, не сопровождается изменениями AUC, тогда как Cmax в плазме крови снижается на 32%. В клинических исследованиях тофацитиниб применяли вне зависимости от приема пищи.
Связывание тофацитиниба с белками плазмы крови составляет приблизительно 40%. Тофацитиниб преимущественно связывается с альбумином и не связывается с αl-кислым гликопротеином. Тофацитиниб в равной степени распределяется между эритроцитами и плазмой крови.
Метаболизм и выведение. Клиренс тофацитиниба примерно на 70% осуществляется посредством метаболизма в печени и на 30% — экскрецией через почки в виде неизмененного тофацитиниба. Метаболизм тофацитиниба преимущественно опосредуется изоферментом CYP3A4 и в меньшей степени — изоферментом CYP2C19. В исследовании меченного радиоактивным изотопом тофацитиниба более 65% общей циркулирующей радиоактивности приходилось на неизмененный тофацитиниб, а остальные 35% — на 8 метаболитов (каждый — менее 8% общей радиоактивности). Фармакологическая активность связана с неметаболизированным тофацитинибом.
Фармакокинетика у пациентов с ревматоидным артритом. Установлено, что у пациентов с ревматоидным артритом AUC тофацитиниба при минимальной и максимальной массе тела (40 и 140 кг) оказались сходными с таковой у пациентов с массой тела 70 кг.
У пожилых пациентов в возрасте 80 лет показатель AUC оказался менее чем на 5% выше по сравнению с пациентами в возрасте 55 лет.
У женщин AUC тофацитиниба на 7% ниже по сравнению с мужчинами.
Полученные данные также показали отсутствие существенных различий (<5%) AUC тофацитиниба у пациентов европеоидной, негроидной и азиатской расы.
Отмечена почти линейная взаимосвязь между массой тела и Vd, что приводит к достижению более высокой Cmax и более низкой Cmin в плазме крови у пациентов с меньшей массой тела. Однако это различие не рассматривается как клинически значимое. Межиндивидуальная вариабельность (коэффициент изменчивости) показателя AUC для тофацитиниба составляет около 27%.
Нарушение функции почек. У пациентов с легким, умеренным или тяжелым нарушением функции почек показатели AUC оказались выше на 37, 43 и 123% соответственно по сравнению со здоровыми добровольцами. У пациентов с терминальной стадией почечной недостаточности вклад диализа в общий клиренс тофацитиниба относительно небольшой.
Нарушение функции печени. У пациентов с легким и умеренным нарушением функции печени показатели AUC на 3 и 65% превышали аналогичные показатели у здоровых добровольцев. Пациенты с тяжелым нарушением функции печени или пациенты с положительными серологическими пробами гепатита B или гепатита C не изучались.
Детский возраст. Исследований фармакокинетики, безопасности и эффективности тофацитиниба у детей не проводилось.
Применение вещества Тофацитиниб
Лечение взрослых пациентов с умеренным или тяжелым активным ревматоидным артритом с неадекватным ответом на один или несколько базисных противовоспалительных препаратов (БПВП).
Применение при беременности и кормлении грудью
Категория действия на плод по FDA — C.
Адекватные, хорошо контролируемые исследования применения тофацитиниба у беременных женщин не проводились. Тофацитиниб не следует применять во время беременности.
Способность тофацитиниба проникать в грудное молоко у человека не изучена. Следует прекратить кормление грудью в период терапии тофацитинибом.
Ограничения к применению
Тофацитиниб следует применять с осторожностью при повышенном риске перфорации органов ЖКТ (например у пациентов с дивертикулитом в анамнезе), у лиц пожилого возраста в связи с высоким риском развития инфекционных заболеваний.
Противопоказания
Повышенная чувствительность к тофацитинибу, тяжелое нарушение функции печени, инфицирование вирусами гепатита В и/или С (наличие серологических маркеров HBV- и HCV-инфекции), Cl креатинина <40 мл/мин, одновременное применение живых вакцин, одновременное применение с биологическими препаратами (такими как ингибиторы ФНО, антагонисты ИЛ-1R, ИЛ-6R, моноклональные анти-CD20-антитела, селективные костимулирующие модуляторы), а также сильными иммунодепрессантами (такими как азатиоприн, циклоспорин и такролимус), поскольку такие комбинации увеличивают вероятность выраженной иммуносупрессии и риск развития инфекции; тяжелые инфекции, активные инфекции, включая локальные, тяжелые инфекционные заболевания; беременность (безопасность и эффективность не исследовались); период грудного вскармливания; детский возраст до 18 лет (безопасность и эффективность не исследовались).
Побочные действия вещества Тофацитиниб
Наиболее частыми серьезными нежелательными реакциями, отмечавшимися на фоне терапии тофацитинибом, были серьезные инфекции.
Самые частые нежелательные реакции на протяжении первых 3 мес контролируемых клинических исследований (с развитием более чем у 2% пациентов, получавших монотерапию тофацитинибом или его комбинацию с БПВП) включали инфекции верхних дыхательных путей, головную боль, назофарингит и диарею.
Отмена терапии в течение первых 3 мес в связи с любой нежелательной реакцией на протяжении двойных слепых плацебо-контролируемых исследований потребовалась в 4,2% случаев для пациентов из группы тофацитиниба и 3,2% для пациентов из группы плацебо. Самыми частыми нежелательными реакциями, которые привели к отмене тофацитиниба, были инфекции. Самые частые инфекции, приводящие к отмене терапии, включали опоясывающий герпес и пневмонию.
Частота нежелательных реакций, перечисленных ниже, представлена по следующей классификации: очень часто — ≥10%; часто — ≥1 и <10%; нечасто — ≥0,1 и <1%; редко — ≥0,01 и <0,1%; очень редко — <0,01%; нет сведений — невозможно определить на основе имеющихся данных.
В каждой частотной группе нежелательные реакции представлены в порядке снижения серьезности.
Инфекционные и паразитарные заболевания: очень часто — назофарингит; часто — пневмония, опоясывающий герпес, бронхит, грипп, синусит, инфекции мочевого тракта, фарингит; нечасто — сепсис, бактериальная пневмония, пневмококковая пневмония, пиелонефрит, воспаление подкожной жировой клетчатки, вирусный гастроэнтерит, вирусная инфекция, простой герпес; редко — туберкулез ЦНС, энцефалит, некротизирующий фасциит, криптококковый менингит, диссеминированный туберкулез, уросепсис, пневмония, вызванная Pneumocystis jiroveci, стафилококковая бактериемия, туберкулез, бактериальный артрит, атипичная инфекция, вызванная микобактериями, инфекция, вызванная комплексом Mycobacterium avium, ЦМВ-инфекция, бактериемия. Среди пациентов, принимавших тофацитиниб, частота серьезных инфекций была выше у лиц старше 65 лет, чем у лиц младше 65 лет.
Со стороны ССС: часто — повышение АД.
Со стороны пищеварительной системы: часто — боль в животе, рвота, гастрит, диарея, тошнота, диспепсия.
Со стороны обмена веществ: часто — гиперлипидемия, дислипидемия; нечасто — дегидратация.
Со стороны нервной системы: часто — головная боль; нечасто — парестезия.
Психические расстройства: часто — бессонница.
Со стороны скелетно-мышечной системы и соединительной ткани: часто — боль в мышцах и костях, артралгии; нечасто — тендинит, отек суставов, мышечное напряжение.
Со стороны крови и лимфатической системы: часто — лейкопения, анемия; нечасто — нейтропения, лимфопения.
Подтвержденные случаи снижения числа лимфоцитов до уровня менее 500 клеток/мм3 сопровождались увеличением частоты подвергавшихся лечению и серьезных инфекций.
Не выявлено какой-либо четкой зависимости между нейтропенией и возникновением серьезных инфекций.
Со стороны дыхательной системы: часто — одышка, кашель; нечасто — застойные явления в придаточных пазухах носа.
Со стороны кожных покровов: часто — сыпь; нечасто — эритема, кожный зуд.
Со стороны печени и желчевыводящих путей: нечасто — жировой гепатоз.
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): нечасто — рак кожи, не связанный с меланомой.
Нарушения, выявленные при клинических и лабораторных исследованиях: часто — повышение активности ферментов печени, КФК, повышение концентрации ЛПНП, холестерина крови (в клинических исследованиях впервые отмечались после первого месяца терапии и в дальнейшем оставались стабильными), повышение массы тела; нечасто — повышение активности трансаминаз, повышение концентрации креатинина в плазме крови, повышение концентрации ГГТ, нарушение функциональных проб печени. При повышении активности печеночных ферментов снижение дозы сопутствующего БПВП, отмена или снижение дозы тофацитиниба приводили к уменьшению или нормализации данного параметра.
Общие нарушения и реакции в месте введения: часто — лихорадка, утомляемость, периферические отеки.
Травмы, интоксикации и осложнения манипуляций: часто — растяжение связок; нечасто — растяжение мышц.
Взаимодействие
Взаимодействия, влияющие на применение тофацитиниба
Поскольку тофацитиниб метаболизируется под действием изофермента CYP3A4, весьма вероятно взаимодействие с препаратами, которые ингибируют или индуцируют данный изофермент. При одновременном применении с мощными ингибиторами изофермента CYP3A4 (например кетоконазол), а также при одновременном применении с одним или несколькими умеренными ингибиторами изофермента CYP3A4 и мощными ингибиторами изофермента CYP2C19 (например флуконазол) экспозиция тофацитиниба увеличивается. Одновременное применение кетоконазола (мощный ингибитор изофермента CYP3A4) и однократной дозы тофацитиниба повышает AUC и Сmах тофацитиниба на 103 и 16% соответственно. Одновременное применение флуконазола (умеренный ингибитор изофермента CYP3A4, а также мощный ингибитор изофермента CYP2C19) увеличивает AUC и Сmax тофацитиниба на 79 и 27% соответственно.
При одновременном применении с мощными индукторами изофермента CYP3A4 (например рифампицин) экспозиция тофацитиниба уменьшается. Одновременное применение рифампицина (мощного индуктора изофермента CYP3A4) снижает AUC и Сmах тофацитиниба на 84 и 74% соответственно.
Вероятность влияния ингибиторов изофермента CYP2C19 или Р-гликопротеина на фармакокинетику тофацитиниба мала.
Одновременное применение такролимуса (слабый ингибитор изофермента CYP3A4) увеличивает AUC тофацитиниба на 21% и снижает Сmax на 9%. Одновременное применение циклоспорина (умеренный ингибитор изофермента CYP3A4) увеличивает AUC тофацитиниба на 73% и снижает Сmax на 17%. Одновременное многократное применение тофацитиниба и мощных иммунодепрессантов у пациентов с ревматоидным артритом не изучалось.
Одновременное применение с метотрексатом (15–25 мг метотрексата 1 раз в неделю) не оказывает влияние на фармакокинетику тофацитиниба.
Взаимодействия, при которых тофацитиниб влияет на фармакокинетику других препаратов
Исследования in vitro показали, что тофацитиниб в концентрациях, даже более чем в 150 раз превышающих Сmах, установившуюся при применении рекомендуемых терапевтических дозировок, существенно не ингибирует и не индуцирует активность основных ЛС, метаболизируемых CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 и CYP3A4. Данные результаты были подтверждены исследованиями in vitro лекарственного взаимодействия, которые показали отсутствие изменений фармакокинетики мидазолама, высокоселективного субстрата изофермента CYP3A4, при одновременном применении с тофацитинибом. Данные in vitro показали, что способность тофацитиниба в терапевтических концентрациях ингибировать такие переносчики, как Р-гликопротеин, органические анионные или катионные переносчики, очень низка.
Одновременное применение с тофацитинибом не оказывало влияние на фармакокинетику пероральпых контрацептивов, левоноргестрела и этинилэстрадиола у здоровых женщин. Одновременное применение тофацитиниба с метотрексатом в дозе 15–25 мг 1 раз в неделю снижало показатели AUC и Сmах метотрексата на 10 и 13% соответственно. Данные изменения фармакокинетики метотрексата не требовали коррекции дозы либо подбора индивидуальных доз метотрексата.
У пациентов с ревматоидным артритом клиренс тофацитиниба с течением времени не изменялся. Это свидетельствует о том, что тофацитиниб не влияет на активность изоферментов CYP у пациентов с ревматоидным артритом. Таким образом, маловероятно, что одновременное применение субстратов изоферментов CYP с тофацитинибом приведет к клинически значимому увеличению их метаболизма у пациентов с ревматоидным артритом. Сопутствующий прием тофацитиниба не оказывал влияние на фармакокинетику метформина, свидетельствуя, что тофацитиниб не воздействует на переносчик органических катионов (ОСТ2) у здоровых добровольцев.
Передозировка
пыт передозировки при применении тофацитиниба отсутствует.
Лечение — симптоматическое и поддерживающее. В случае передозировки рекомендуется контроль состояния пациента на предмет развития признаков и симптомов нежелательных реакций. При развитии нежелательных реакций следует назначить соответствующую терапию. Специфического антидота не существует.
Данные по фармакокинетике у здоровых добровольцев, получавших однократные дозы до 100 мг, свидетельствуют, что около 95% введенной дозы выводится в течение 24 ч.
Меры предосторожности
Серьезные инфекции
У пациентов с ревматоидным артритом, получающих иммуномодуляторы, включая биологические препараты и тофацитиниб, отмечены серьезные и в отдельных случаях смертельные инфекции, вызванные бактериальными, микобактериальными, грибковыми, вирусными или другими оппортунистическими возбудителями. Самые частые серьезные инфекции, отмеченные при применении тофацитиниба, включают пневмонию, воспаление подкожной клетчатки, опоясывающий герпес и инфекцию мочевых путей. Из числа оппортунистических инфекций при применении тофацитиниба отмечены случаи развития туберкулеза и других микобактериальных инфекций, криптококкоза, кандидоза пищевода, опоясывающего лишая с поражением различных дерматом, ЦМВ-инфекции, а также полиомавирусной (вирус BK) инфекции. У некоторых пациентов отмечали диссеминированные заболевания, чаще всего при одновременном применении иммунодепрессантов (метотрексат или ГКС), которые сами по себе и в дополнение к основному заболеванию — ревматоидному артриту — могут предрасполагать к развитию инфекций. Также возможно развитие и иных серьезных инфекций, которые не были зарегистрированы в клинических исследованиях (например гистоплазмоз, кокцидиомикоз и листериоз).
Тофацитиниб не следует применять у пациентов с активной инфекцией, включая локальную. Перед применением тофацитиниба следует оценить соотношение риск/польза от терапии у пациентов с хронической или рецидивирующей инфекцией, после контакта с больным туберкулезом с наличием тяжелой или оппортунистической инфекции в анамнезе, у пациентов, которые жили или недавно посетили эндемичные районы по туберкулезу или микозам, а также у пациентов с предрасположенностью к развитию инфекции. Пациенты подлежат внимательному наблюдению на предмет развития признаков и симптомов инфекции во время и после терапии тофацитинибом.
Тофацитиниб следует временно отменить, если у пациента развилась серьезная инфекция, оппортунистическая инфекция или сепсис, до тех пор, пока не будет установлен контроль за состоянием пациента. При развитии новой инфекции на фоне применения тофацитиниба пациент подлежит быстрому и полному диагностическому обследованию по аналогии с пациентом, страдающим иммунодефицитом. Показано назначение соответствующей антибактериальной терапии, а также тщательное динамическое наблюдение.
Поскольку пожилые пациенты обычно характеризуются более высокой частотой развития инфекций, в подобных случаях также следует соблюдать осторожность.
Туберкулез
Перед применением тофацитиниба следует провести обследование па предмет признаков латентной или активной туберкулезной инфекции.
Перед началом терапии тофацитинибом у пациентов с латентным или активным туберкулезом в анамнезе, при отсутствии подтверждения адекватного курса противотуберкулезной терапии, а также у пациентов с отрицательным результатом исследования на латентный туберкулез, но наличием факторов риска туберкулезной инфекции, следует провести соответствующую противотуберкулезную терапию. При принятии решения относительно необходимости проведения противотуберкулезной терапии у каждого конкретного пациента рекомендуется проконсультироваться с фтизиатром.
Пациенты подлежат тщательному наблюдению па предмет развития признаков туберкулеза, включая пациентов с отрицательным результатом теста на латентный туберкулез до начала терапии.
Частота развития туберкулеза при применении тофацитиниба в рамках мировой программы клинической разработки составила 0,1–0,2%. Пациенты с латентным туберкулезом перед началом терапии тофацитинибом подлежат стандартной aнтимикобактериальной терапии.
Реактивация вирусных инфекций
Реактивация вирусных инфекций описана при применении терапии БПВП. Случаи реактивации вируса герпеса (например опоясывающий герпес) также описаны в клинических исследованиях тофацитиниба. Влияние тофацитиниба на реактивацию хронического вирусного гепатита неизвестно. Пациентов с положительным результатом тестирования на гепатиты B и C исключили из клинических исследований. Перед началом терапии тофацитинибом следует провести скрининг на предмет наличия вирусного гепатита.
Злокачественные и лимфопролиферативные заболевания (за исключением рака кожи, не относящегосяся к меланоме (РКНМ)
Существует возможность, что тофацитиниб влияет на защиту организма от злокачественных новообразований. Влияние терапии тофацитинибом на развитие и течение злокачественных новообразований неизвестно, однако в клинических исследованиях регистрировали случаи развития злокачественных новообразований.
У пациентов, получавших лечение тофацитинибом, были зарегистрированы случаи лимфомы. Несмотря на то что у пациентов с ревматоидным артритом, особенно с высокоактивной формой заболевания, наблюдается более высокий риск (в несколько раз выше) развития лимфомы по сравнению с общей популяцией, роль ингибирования JAK, если таковая имеется, в развитии лимфомы неизвестна.
PKНM. Сообщалось о случаях развития РКНМ у пациентов, получавших терапию тофацитинибом. Рекомендуется проводить периодическое обследование кожи у пациентов с повышенным риском развития рака кожи.
Случаи перфорации органов ЖКТ
В клинических исследованиях пациентов с ревматоидным артритом описаны случаи перфорации органов ЖКТ, хотя роль ингибирования JAK при этих явлениях неизвестна. Такие случаи в основном были описаны как перфорация дивертикула, перитонит, абсцесс в брюшной полости и аппендицит. Все пациенты, у которых развилась перфорация органов ЖКТ, получали сопутствующую терапию НПВС и/или ГКС. Относительный вклад сопутствующей терапии и применения тофацитиниба при развитии перфорации органов ЖКТ неизвестен.
Тофацитиниб следует с осторожностью применять у пациентов с повышенным риском перфорации органов ЖКТ (например у пациентов с дивертикулитом в анамнезе). Пациенты с новыми симптомами со стороны органов ЖКТ подлежат немедленному обследованию для раннего выявления перфорации органов ЖКТ.
Лабораторные показатели
Лимфоциты: случаи снижения числа лимфоцитов до уровня <500 клеток/мм3 были связаны с увеличением частоты серьезных инфекций, которые потребовали терапии. Не рекомендуется начинать терапию тофацитинибом у пациентов с низким числом лимфоцитов (т.е. <500 клеток/мм3). Если у пациента подтверждено снижение абсолютного числа лимфоцитов до уровня <500 клеток/мм3, лечение препаратом тофацитиниб не рекомендуется. Число лимфоцитов необходимо контролировать на исходном уровне и затем каждые 3 мес.
Нейтрофилы: лечение тофацитинибом сопровождалось увеличением частоты развития нейтропении (<2000 клеток/мм3) по сравнению с плацебо. Лечение тофацитинибом пациентов с низкой концентрацией нейтрофилов (абсолютное число нейтрофилов (АЧН) <1000 клеток/мм3) не рекомендуется. У пациентов со стойким снижением АЧН до 500–1000 клеток/мм3 следует снизить дозу тофацитиниба или прекратить лечение до достижения концентрации АЧН >1000 клеток/мм3. У пациентов с подтвержденным АЧН <500 клеток/мм3 лечение не рекомендуется. Уровень нейтрофилов следует контролировать на исходном уровне и после 4–8 нед терапии, а затем каждые 3 мес.
Гемоглобин: не рекомендуется начинать терапию тофацитинибом у пациентов с низким уровнем гемоглобина (<9 г/дл). Лечение тофацитинибом следует прекратить у пациентов с уровнем гемоглобина <8 г/дл, либо при снижении уровня гемоглобина на 2 г/дл и более на фоне лечения. Гемоглобин следует контролировать на начальном этапе терапии, после 4–8 нед терапии, а затем каждые 3 мес.
Липиды: лечение тофацитинибом сопровождается повышением уровня липидов крови — общего холестерина, холестерина ЛПНП, а также холестерина ЛПВП. Максимальный эффект обычно отмечался в течение 6 нед. Оценку липидных параметров следует выполнять по прошествии около 4–8 нед после начала терапии. Применение статинов у пациентов с повышенной концентрацией общего холестерина и холестерина ЛПНП на фоне терапии тофацитинибом позволяет достичь исходных показателей.
Вакцинация
Информация по ответу на вакцинацию или вторичной трансмиссии инфекции при введении живых вакцин пациентам, получающим тофацитиниб, до настоящего времени отсутствует. Не следует вводить живые вакцины одновременно с тофацитинибом. Рекомендуется до начала применения тофацитиниба всем пациентам выполнять необходимую иммунизацию в соответствии с современными рекомендациями по вакцинации.
Пациенты с нарушением функции почек
В клинических исследованиях тофацитиниб не изучали у пациентов с исходным Cl креатинина <40 мл/мин (расчет производился по формуле Кокрофта-Голта) (см. «Противопоказания»).
Влияние на способность управлять автомобилем и другими сложными механизмами. Исследования влияния тофацитиниба на способность к управлению автомобилем и работе с механизмами не проводились.
Способ применения и дозы
Внутрь, вне зависимости от приема пищи.
Тофацитиниб можно применять в качестве монотерапии или в комбинации с метотрексатом или другими небиологическими БПВП.
Рекомендованная доза составляет 5 мг 2 раза в день. У некоторых пациентов может потребоваться увеличение дозы до 10 мг 2 раза в день в зависимости от клинического ответа на терапию.