Содержание
Русское название
Английское название
Vemurafenib.
Латинское название вещества Вемурафениб
Vemurafenibum (род. Vemurafenibi).
Химическое название
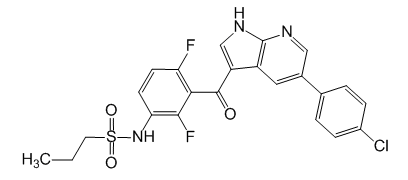
N-(3-{[5-(4-Хлорфенил)-1H-пирроло[2,3-b]пиридин-3-ил]карбонил}-2,4-дифторфенил)пропан-1-сульфонамид.
Брутто формула
C23H18ClF2N3O3S
Фармакологическая группа вещества Вемурафениб
Противоопухолевые средства — ингибиторы протеинкиназ.
Нозологическая классификация
- (C43) Злокачественная меланома кожи;
Код CAS
1029872-54-5
Фармакологическое действие
Фармакологическое действие: противоопухолевое.
Характеристика
Вемурафениб — вещество с низкой растворимостью и проницаемостью (класс 4 по системе биофармацевтической классификации). Фармакокинетические параметры вемурафениба оценивали методом некомпартментного анализа, а также с помощью популяционного фармакокинетического анализа. Фармакокинетика вемурафениба имеет дозозависимый характер в диапазоне от 240 до 960 мг при приеме 2 раза в сутки. Линейность фармакокинетики также подтверждена данными популяционного фармакокинетического анализа.Фармакология
Вемурафениб является ингибитором серин-треонинкиназы, кодируемой геном BRAF (v-raf murine sarcoma viral oncogene homolog B1). В результате мутаций в гене BRAF происходит конститутивная активация онкогенного белка BRAF и как следствие — пролиферация клеток при отсутствии факторов роста.
Согласно проведенным биохимическим исследованиям, вемурафениб является мощным ингибитором BRAF-киназ с активирующими мутациями в кодоне 600.
Данный ингибирующий эффект был подтвержден в ходе реакции фосфорилирования внеклеточной сигналрегулирующей киназы и клеточной антипролиферации в доступных клеточных линиях меланомы, экспрессирующих ген BRAF с мутациями V600. В тестах антипролиферации в клеточных линиях с мутациями V600 (линии V600E, V600R, V600D и V600K) концентрация полумаксимального ингибирования (IC50) варьировала от 0,016 до 1,131 мкмоль, в то время как IС50 в отношении клеточных линий гена BRAF дикого типа составляла 12,06 и 14,32 мкмоль соответственно.
Вемурафениб — вещество с низкой растворимостью и проницаемостью (класс 4 по системе биофармацевтической классификации). Фармакокинетические параметры вемурафениба оценивали методом некомпартментного анализа, а также с помощью популяционного фармакокинетического анализа. Фармакокинетика вемурафениба имеет дозозависимый характер в диапазоне от 240 до 960 мг при приеме 2 раза в сутки. Линейность фармакокинетики также подтверждена данными популяционного фармакокинетического анализа.
Всасывание. Абсолютная биодоступность вемурафениба в виде таблеток 240 мг неизвестна. При приеме вемурафениба в однократной дозе 960 мг Тmax составляет приблизительно 4 ч. При многократном приеме вемурафениба в дозе 960 мг 2 раза в день наблюдается накопление ЛС, которое характеризуется высокой межиндивидуальной вариабельностью. Средние показатели AUC0–8 и Сmax (± стандартное отклонение) в 1-е сут составили (22,1±12,7) мкг·ч/мл и (4,1±2,3) мкг/мл соответственно. В ходе некомпартментного анализа при приеме вемурафениба в дозе 960 мг 2 раза в день AUC на 15-е сут увеличивалась в 15–17 раз по сравнению с AUC в 1-е сут, Сmax на 15-е сут увеличилась в 13–14 раз по сравнению с Сmax в 1-е сут. В равновесном состоянии AUC0–8 и Сmax составили (380,2±143,6) мкг·ч/мл и (56,7±21,8) мкг/мл соответственно.
Пища, богатая жирами, повышает экспозицию вемурафениба при однократном применении в дозе 960 мг. Средние геометрические показатели Сmax и AUC увеличивались при приеме вемурафениба с пищей по сравнению с приемом натощак в 2,5 и с 4,6 до 5,1 раза соответственно. Медиана Тmax увеличивалась с 4 до 7,5 ч при однократном приеме вемурафениба с пищей. Данные по влиянию приема пищи на экспозицию вемурафениба в равновесном состоянии отсутствуют. Продолжительный прием вемурафениба натощак может привести к значимому снижению экспозиции вемурафениба в равновесном состоянии по сравнению с приемом вемурафениба с пищей или незадолго до приема пищи. Ожидается, что при нерегулярном приеме вемурафениба натощак экспозиция вемурафениба в равновесном состоянии изменится незначительно ввиду высокой степени накопления вемурафениба в равновесном состоянии. Безопасность и эффективность вемурафениба в опорных исследованиях были изучены у пациентов, принимавших вемурафениб как с пищей, так и отдельно от приема пищи.
Возможно изменение экспозиции вемурафениба в зависимости от состава, объема и кислотности (pH) жидкости ЖКТ, моторики и времени прохождения пищи, состава желчи.
В равновесном состоянии (достигается на 15-е сут у 80% пациентов) средняя экспозиция вемурафениба в плазме крови характеризуется стабильностью на протяжении 24 ч, о чем свидетельствует среднее соотношение концентрации в плазме крови до и через 2–4 ч после приема утренней дозы, равное 1,13.
После перорального приема константа скорости всасывания у пациентов с метастатической меланомой составляет 0,19 ч-1 (межиндивидуальная вариабельность 101%).
Распределение. По данным популяционного анализа, кажущийся Vd вемурафениба у пациентов с метастатической меланомой составляет 91 л (межиндивидуальная вариабельность 64,8%). Вемурафениб характеризуется высокой степенью связывания с белками плазмы крови человека in vitro (более 99%).
Метаболизм. Изофермент цитохрома P450 (CYP3А4) — основной фермент, участвующий в метаболизме вемурафениба in vitro. У человека также обнаружены продукты конъюгации с глюкуроновой кислотой и продукты гликозилирования. Соотношение вемурафениба и его метаболитов было изучено в ходе клинического исследования после однократного приема вемурафениба с 14C-радиоактивной меткой. В плазме крови вемурафениб содержится преимущественно в неизмененном виде (>95%), тогда как метаболиты составляют не более 5%.
Выведение. По данным популяционного анализа, кажущийся клиренс вемурафениба у пациентов с метастатической меланомой составляет 29,3 л/день (межиндивидуальная вариабельность 31,9%), медиана T1/2 вемурафениба составляет 51,6 ч (диапазон индивидуальных значений между 5-м и 95-м перцентилем составляет 29,8–119,5 ч).
Согласно исследованию, в среднем 95% дозы вемурафениба выводится в течение 18 дней. Большая часть (94%) вемурафениба в неизмененном виде и в виде метаболитов выводится кишечником, менее 1% — почками. Выведение препарата в неизмененном виде с желчью может быть важным путем выведения. Однако поскольку абсолютная биодоступность вемурафениба неизвестна, значение влияния печеночной и почечной экскреции на его клиренс в неизмененном виде также не может быть оценено. Вемурафениб является субстратом и ингибитором P-gp in vitro.
Фармакокинетика у особых групп пациентов
Пациенты пожилого возраста. Согласно результатам популяционного фармакокинетического анализа, возраст пациентов не оказывает статистически значимое влияние на фармакокинетические параметры вемурафениба.
Пол. Согласно результатам популяционного фармакокинетического анализа, у мужчин кажущийся клиренс вемурафениба больше на 17%, а кажущийся Vd — на 48% по сравнению с женщинами. При этом различия в экспозиции вемурафениба относительно невелики, что указывает на отсутствие необходимости корректировать дозу в зависимости от пола пациента, индекса массы тела или массы тела.
Пациенты детского возраста и подростки. Исследования фармакокинетики вемурафениба у пациентов детского возраста и подростков не проводились.
Пациенты с нарушением функции почек. Согласно результатам популяционного фармакокинетического анализа данных пациентов с метастатической меланомой, легкая и средняя степень почечной недостаточности (Cl креатинина >40 мл/мин) не оказывает влияние на кажущийся клиренс вемурафениба. Клинические данные и данные по фармакокинетике у пациентов с тяжелой степенью почечной недостаточности не позволяют определить необходимость коррекции дозы.
Пациенты с нарушением функции печени. Вемурафениб преимущественно выводится с желчью. Согласно результатам популяционного фармакокинетического анализа данных пациентов с метастатической меланомой, повышение активности ACT и АЛТ до значения, в 3 раза превышающего ВГН, не оказывает влияние на кажущийся клиренс вемурафениба. Клинические данные и данные по фармакокинетике у пациентов с тяжелой степенью печеночной недостаточности не позволяют определить влияние нарушения метаболической или экскреторной функции печени на фармакокинетику вемурафениба.
Применение вещества Вемурафениб
Неоперабельная или метастатическая меланома с BRAF V600 мутацией у взрослых пациентов в виде монотерапии.
Применение при беременности и кормлении грудью
Исходя из механизма действия, вемурафениб может вызвать повреждение плода при применении у беременных женщин (см. «Меры предосторожности»). Адекватные и надлежащим образом контролируемые исследования у беременных женщин не проводились. Женщины репродуктивного возраста и мужчины должны быть предупреждены о необходимости использовать соответствующие методы контрацепции во время терапии вемурафенибом и по крайней мере в течение 2 мес после отмены лечения. Если вемурафениб применяется в период беременности или беременность наступила во время лечения, пациентка должна быть предупреждена о потенциальной опасности для плода.
Нет данных об экскреции вемурафениба в грудное молоко человека. Поскольку многие ЛС экскретируются в грудное молоко человека и вемурафениб может вызвать серьезные побочные реакции у ребенка, следует принять решение о прекращении грудного вскармливания или об отмене ЛС, учитывая важность этого ЛС для матери.
Ограничения к применению
Одновременный прием с варфарином, мощными ингибиторами и индукторами изофермента CYP3A4, глюкуронирования и/или транспортных белков (включая P-gp и гликопротеин), ЛС, являющимися субстратами изофермента CYP1A2; совместное применение с субстратами изофермента CYP2C8 с узким терапевтическим диапазоном (см. «Взаимодействие»).
Противопоказания
Повышенная чувствительность к вемурафенибу, беременность и период грудного вскармливания, детский возраст до 18 лет (эффективность и безопасность применения не установлены), не поддающиеся коррекции нарушения водно-электролитного баланса (в т.ч. дисбаланс магния), синдром удлиненного интервала QT, прием ЛС, способствующих удлинению интервала QT, корригированный интервал QT (QTc) >500 мс до начала терапии, тяжелая степень почечной и печеночной недостаточности.
Побочные действия вещества Вемурафениб
Для описания частоты нежелательных реакций используется следующая классификация: очень часто (больше или равно 10%); часто (больше или равно 1% и <10%); нечасто (больше или равно 0,1% и <1%); редко (больше или равно 0,01% и <0,1%); очень редко (<0,01%).
Наиболее частыми нежелательными реакциями (>30%) при применении вемурафениба были артралгия, повышенная утомляемость, сыпь, реакция фотосенсибилизации, тошнота, диарея, алопеция, зуд и папиллома кожи. Сообщалось об очень частых случаях плоскоклеточной карциномы кожи, лечение, как правило, было хирургическим.
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): очень часто — плоскоклеточная карцинома кожи, себорейный кератоз, папиллома кожи; часто — базальноклеточный рак, новые первичные меланомы; нечасто — плоскоклеточная карцинома некожной локализации.
Со стороны обмена веществ: очень часто — снижение аппетита, снижение массы тела.
Со стороны нервной системы: очень часто — головная боль, дисгевзия (искажение вкусовых восприятий), периферическая нейропатия; часто — паралич лицевого нерва, головокружение.
Со стороны органа зрения: часто — увеит, включая ирит; нечасто — окклюзия вен сетчатки.
Со стороны сосудов: нечасто — васкулит.
Со стороны дыхательной системы, органов грудной клетки и средостения: очень часто — кашель.
Со стороны ЖКТ: очень часто — диарея, рвота, тошнота, запор.
Со стороны кожи и подкожных тканей: очень часто — реакция фотосенсибилизации, актинический кератоз, сыпь, макулопапулезная сыпь, папулезная сыпь, зуд, гиперкератоз, эритема, алопеция, сухость кожи, солнечный ожог, синдром ладонно-подошвенной эритродизестезии; часто — панникулит, включая узловатую эритему, фолликулярный кератоз, фолликулит; нечасто — токсический эпидермальный некролиз, синдром Стивенса-Джонсона.
Со стороны скелетно-мышечной и соединительной ткани: очень часто — артралгия, миалгия, боли в конечностях, костно-мышечная боль, боли в спине, артрит.
Прочие: очень часто — повышенная утомляемость, лихорадка, периферические отеки, астения.
Лабораторные и инструментальные данные: очень часто — повышение активности ГГТП**; часто — повышение активности АЛТ*, ЩФ*, повышение концентрации билирубина*; нечасто — повышение активности ACT**.
* 3-й степени тяжести.
** 3-й или 4-й степени тяжести.
Реакции гиперчувствительности. При применении вемурафениба сообшалось о случаях серьезных реакций гиперчувствительности, в т.ч. анафилаксии. Тяжелые реакции гиперчувствительности могут включать генерализованную сыпь, эритему или артериальную гипотензию. При развитии тяжелых реакций гиперчувствительности дальнейший прием вемурафениба следует прекратить.
Пострегистрационное применение
Доброкачественные, злокачественные и неуточненные новообразования (включая кисты и полипы): частота неизвестна — прогрессирование предшествующего хронического миеломоноцитарного лейкоза с мутацией в гене NRAS (частота неизвестна), прогрессирование предшествующей аденокарциномы поджелудочной железы с мутацией в гене KRAS.
Со стороны кожи и подкожных тканей: частота неизвестна — лекарственная сыпь с эозинофилией и системными симптомами (DRESS-синдром).
Со стороны печени и желчевыводящих путей: нечасто — поражение печени.
Со стороны ЖКТ: нечасто — панкреатит.
Со стороны крови и лимфатической системы: нечасто — нейтропения.
Травмы, интоксикации и осложнения манипуляций: частота неизвестна — лучевая болезнь, включая лучевой дерматит, лучевое поражение кожи, лучевой пневмонит, лучевой эзофагит, лучевой проктит, лучевой гепатит, лучевой цистит и лучевой некроз (см. «Меры предосторожности»).
Лабораторные и инструментальные данные: отклонения лабораторных параметров, характеризующих функции печени, включая повышение активности АЛТ (в 5 и более раз выше ВГН), ЩФ (в 2 и более раза выше ВГН), АЛT (в 3 и более раза выше ВГН) с одновременным повышением концентрации билирубина (более чем в 2 раза выше ВГН).
Пациенты пожилого возраста. У пациентов в возрасте 65 и более лет более вероятно развитие нежелательных реакций, в т.ч. таких как плоскоклеточная карцинома кожи, снижение аппетита и нарушения со стороны сердца.
Пол. При применении вемурафениба среди нежелательных реакций 3-й степени тяжести, наблюдавшихся более часто у женщин, чем у мужчин, были сыпь, артралгия и фотосенсибилизация.
Взаимодействие
Взаимодействие вемурафениба и субстратов цитохрома Р450 (CYP). Результаты исследования лекарственных взаимодействий in vivo, проведенного с участием пациентов с метастатической меланомой, свидетельствуют о том, что вемурафениб является умеренным ингибитором изофермента CYP1А2 и индуктором изофермента CYP3A4. Вемурафениб может уменьшать экспозицию веществ, метаболизирующихся преимущественно при участии изофермента CYP3A4. В связи с этим возможно уменьшение эффективности контрацептивных ЛС, метаболизирующихся при участии изофермента CYP3A4.
Одновременное применение вемурафениба с ЛС, метаболизирующимися посредством изоферментов CYP1А2 и CYP3A4 и обладающими узким терапевтическим индексом не рекомендуется. При невозможности избежать их совместного применения следует соблюдать осторожность, поскольку вемурафениб может увеличивать экспозицию ЛС — субстратов изофермента СYP1A2 — и снижать экспозицию ЛС — субстратов изофермента CYP3A4 — в плазме крови. При необходимости рекомендуется снижение дозы ЛС, являющегося субстратом изофермента CYP1А2. В ходе проведения клинического исследования было выявлено, что совместное применение с вемурафенибом повышает AUC кофеина (субстрат изофермента СYP1A2) в среднем в 2,6 раза (максимально в 5 раз), тогда как AUC мидазолама (субстрат изофермента CYP3A4) снижается в среднем на 39% (максимально до 80%). AUC декстрометорфана (субстрат CYP2D6) и его метаболита декстрофана увеличивалась приблизительно на 47% вследствие эффекта на кинетику декстрометорфана, который может не быть опосредован ингибированием изофермента CYP2D6.
В исследовании in vitro вемурафениб в концентрации 10 мкмолей вызывал слабое ингибирование изофермента CYP2B6. Неизвестно, будет ли вемурафениб при достижении Css 100 мкмолей в крови пациентов (примерно 50 мкг/мл) уменьшать содержание субстратов изофермента CYP2B6, таких как бупропион, при их одновременном применении.
Одновременное применение вемурафениба и варфарина (субстрат изофермента CYP2C9) может приводить к увеличению AUC последнего на 18%. Следует соблюдать осторожность и предусмотреть дополнительный мониторинг МНО в случае, если вемурафениб используется одновременно с варфарином. В ходе исследований in vitro было показано, что вемурафениб является умеренным ингибитором изофермента СYP2C8. Значение данного наблюдения для человека неизвестно, однако риск клинически значимого влияния на субстраты изофермента CYP2C8 при совместном применении не может быть исключен. Следует соблюдать осторожность при совместном применении вемурафениба и субстратов изофермента CYP2C8 с узким терапевтическим диапазоном, поскольку вемурафениб может повышать концентрацию последних.
Во избежание взаимодействий с ЛС после прекращения применения вемурафениба может потребоваться период вымывания продолжительностью 8 дней.
Взаимодействие вемурафениба с переносчиками ЛС. В ходе исследований in vitro было показано, что вемурафениб является субстратом и ингибитором P-gp и BCRP (breast cancer resistance protein, белок устойчивости рака молочной железы). Клиническое значение этих данных неизвестно.
Нельзя исключать, что при одновременном применении с вемурафенибом возможно повышение экспозиции ЛС, транспортируемых при помощи P-gp (например алискирен, колхицин, дигоксин, эверолимус, фексофенадин) или BCRP (например метотрексат, митоксантрон, розувастатин). В ходе клинического исследования лекарственного взаимодействия с применением дигоксина (субстрат P-gp) было выявлено, что при использовании многократных пероральных доз вемурафениба (960 мг 2 раза в день) увеличивалась экспозиция однократной пероральной дозы дигоксина (увеличение общей системной экспозиции (AUClast) и Cmax дигоксина в 1,8 и 1,5 раза соответственно). Необходимо соблюдать осторожность при одновременном применении вемурафениба и субстратов P-gp. В случае необходимости рекомендуется снизить дозу сопутствующего ЛС — субстрата P-gp.
В ходе исследований in vitro было показано, что вемурафениб является ингибитором белка BSEP (Bile Salt Export Pump, экспортирующая помпа желчных кислот). Клиническое значение этих данных неизвестно.
Данные о влиянии вемурафениба на другие переносчики отсутствуют.
Влияние сопутствующих препаратов на вемурафениб. В исследованиях in vitro показано, что метаболизм вемурафениба происходит при участии изофермента CYP3A4 и путем глюкуронирования. Следует соблюдать осторожность при одновременном применении вемурафениба и мощных ингибиторов изофермента CYP3A4, глюкуронирования и/или транспортных белков (например ритонавир, саквинавир, телитромицин, кетоконазол, итраконазол, вориконазол, позаконазол, нефазодон, атазанавир).
Следует также избегать одновременного применения вемурафениба с мощными индукторами P-gp, глюкуронирования, изофермента CYP3A4 (например рифампицин, рифабутин, карбамазепин, фенитоин или зверобой продырявленный) из-за возможного снижения экспозиции вемурафениба.
В исследованиях in vitro показано, что вемурафениб является субстратом P-gp и BCRP. Данные по влиянию индукторов или ингибиторов P-gp и BCRP на экспозицию вемурафениба отсутствуют. Нельзя исключить, что на фармакокинетические параметры вемурафениба могут оказывать влияние препараты, ингибирующие или влияющие на P-gp (например верапамил, кларитромицин, циклоспорин, ритонавир, хинидин, дронедарон, амиодарон, итраконазол, ранолазин) и BCRP (циклоспорин, гефитиниб). Данные о том, является ли вемурафениб субстратом для других переносчиков, отсутствуют.
Усиление действия лучевой терапии. У пациентов, получающих вемурафениб, наблюдалось усиление токсического действия лучевой терапии (см. «Меры предосторожности» и «Побочные действия» Пострегистрационное применение). В большинстве случаев пациенты получали лучевую терапию в режиме не менее 2 Гр/сут (гипофракционный режим).
Передозировка
Специфического антидота, который можно было бы использовать в случаях передозировки вемурафениба, не существует. При появлении нежелательных реакций необходимо назначить соответствующее симптоматическое лечение. Дозолимитирующая токсичность вемурафениба проявлялась в виде сыпи с зудом и повышенной утомляемости. При подозрении на передозировку необходимо прекратить прием вемурафениба и назначить поддерживающую терапию.
Меры предосторожности
Перед применением вемурафениба пациенты должны пройти валидированный тест на наличие BRAF мутации V600. Эффективность и безопасность вемурафениба у пациентов, опухоли которых несут редкие BRAF мутации V600, отличные от V600E и V600K, не была убедительно доказана. Вемурафениб не следует применять у пациентов со злокачественной меланомой, экспрессирующей BRAF дикого типа.
Реакции гиперчувствительности. При применении вемурафениба сообщалось о случаях серьезных реакций гиперчувствительности, в т.ч. анафилаксии. Тяжелые реакции гиперчувствительности могут включать генерализованную сыпь, эритему или артериальную гипотензию. При развитии тяжелых реакций гиперчувствительности дальнейший прием вемурафениба следует прекратить.
Дерматологические реакции. При применении вемурафениба в опорном клиническом исследовании сообщалось о тяжелых дерматологических реакциях, включая редкие случаи синдрома Стивенса-Джонсона и токсического эпидермального некролиза. Зарегистрированы случаи появления лекарственной сыпи с эозинофилией и системными симптомами (DRESS-синдрома) на фоне применения вемурафениба.
При развитии тяжелых дерматологических реакций дальнейший прием вемурафениба следует прекратить.
Усиление действия лучевой терапии. У пациентов, получающих лучевую терапию до, во время или после применения вемурафениба, отмечались случаи повышения чувствительности к лучевой терапии и лучевой дерматит (см. «Взаимодействие» и «Побочные действия», Пострегистрационное применение). Необходимо соблюдать осторожность при применении вемурафениба одновременно или последовательно с лучевой терапией.
Удлинение интервалы QT. При применении вемурафениба наблюдалось удлинение интервала QT, пропорциональное экспозиции вемурафениба. Удлинение интервала QT может способствовать увеличению риска возникновения желудочковых аритмий, включая желудочковую тахикардию типа «пируэт». Применение вемурафениба не рекомендуется у пациентов с неподдающимися коррекции нарушениями водно-электролитного баланса (в т.ч. баланс магния), синдромом удлиненного интервала QT, а также у пациентов, получающих ЛС, способствующие удлинению интервала QT.
ЭКГ и исследование водно-электролитного баланса (в т.ч. дисбаланс магния) необходимо выполнить перед началом приема и после изменения дозы вемурафениба. В дальнейшем регистрацию ЭКГ и определение содержания электролитов рекомендуется проводить ежемесячно в течение первых 3 мес приема вемурафениба, а затем через каждые 3 мес или чаще при наличии клинических симптомов. Если интервал QTc >500 мс, начинать прием вемурафениба не рекомендуется. Если во время лечения интервал QTc составит >500 мс, необходимо временно прервать прием вемурафениба, устранить нарушения водно-электролитного баланса (в т.ч. баланса магния) и добиться коррекции факторов риска удлинения интервала QT (например ХСН, брадиаритмия). После уменьшения интервала QTc до значения, составляющего <500 мс, следует возобновить прием вемурафениба в более низкой дозе. Если после коррекции сопутствующих факторов риска значение интервала QTc составляет >500 мс и отличается от исходного, зарегистрированного перед началом приема, более чем на 60 мс, прием вемурафениба необходимо прекратить.
Офтальмологические реакции. При применении вемурафениба были зарегистрированы серьезные офтальмологические реакции, включавшие увеит (в т.ч. ирит) и окклюзию вен сетчатки. Лечащему врачу рекомендуется регулярно наблюдать за пациентом на предмет развития офтальмологических реакций.
Совместное применение с ипилимумабом. При совместном применении вемурафениба (960 или 720 мг 2 раза в день) с ипилимумабом (3 мг/кг) были зарегистрированы бессимптомное повышение активности трансаминаз и концентрации билирубина 3-й степени тяжести. На основании этих данных совместное применение вемурафениба и ипилимумаба не рекомендуется.
Злокачественные новообразования
Плоскоклеточная карцинома кожи. У пациентов, получавших вемурафениб, описаны случаи развития плоскоклеточной карциномы кожи, в т.ч. случаи, классифицированные как кератоакантома и смешанная кератоакантома. Всем пациентам рекомендуется пройти обследование у дерматолога перед началом приема вемурафениба. При возникновении любых подозрительных поражений кожи их необходимо иссечь, направить на дерматопатологическое исследование и провести терапию в соответствии с местными стандартами оказания медицинской помощи. При развитии у пациента плоскоклеточной карциномы кожи рекомендуется продолжить лечение вемурафенибом без коррекции дозы. Врач должен проводить обследование пациента ежемесячно во время терапии и в течение 6 мес после лечения вемурафенибом или до начала другой противоопухолевой терапии. Пациенты должны быть проинструктированы о необходимости информировать врача о появлении любых изменений на коже.
Плоскоклеточная карцинома другой (некожной) локализации. У пациентов, получавших вемурафениб, зарегистрированы случаи развития плоскоклеточной карциномы другой локализации. Перед началом приема вемурафениба необходимо провести обследование головы и шеи, состоящее как минимум из визуального осмотра слизистой оболочки полости рта и пальпации лимфатических узлов, и повторять это обследование через каждые 3 мес во время приема вемурафениба. Кроме того, перед началом приема вемурафениба необходимо выполнить компьютерную томографию органов грудной клетки, а во время приема повторять это обследование через каждые 6 мес.
Перед началом приема вемурафениба и по завершении терапии или при наличии клинических симптомов рекомендуется проводить исследования органов малого таза (у женщин) и прямой кишки.
После прекращения приема вемурафениба обследование с целью выявления плоскоклеточной карциномы другой локализации необходимо продолжать в течение 6 мес или до начала другой противоопухолевой терапии. Выявленные патологические изменения следует вести в соответствии с клиническом практикой.
Новый очаг первичной меланомы. При применении вемурафениба были зарегистрированы случаи возникновения новых очагов первичной меланомы. Вo всех случаях лечение было хирургическим, и пациенты продолжили терапию без коррекции дозы. Обследование на предмет поражений кожи следует проводить в соответствии с рекомендациями, приведенными выше для плоскоклеточной карциномы кожи.
Другие злокачественные новообразования. Исходя из механизма действия, вемурафениб может вызывать прогрессирование злокачественных новообразований, ассоциированных с мутациями в гене RAS. Требуется тщательно рассмотреть вопрос об отношении ожидаемой пользы к возможному риску применения вемурафениба у пациентов с ранее перенесенными или сопутствующими злокачественными новообразованиями, ассоциированными с мутациями в гене RAS.
Поражение печени. При применении вемурафениба зарегистрированы случаи поражения печени, включая тяжелые. На фоне приема вемурафениба могут возникнуть патологические изменения лабораторных параметров, характеризующих функцию печени. Перед началом приема вемурафениба необходимо оценить активность печеночных ферментов (трансаминаз и ЩФ), а также концентрацию билирубина, а во время приема следует контролировать эти параметры ежемесячно или чаще при возникновении клинических симптомов. При выявлении патологических изменений лабораторных параметров следует уменьшить дозу, прервать или прекратить прием вемурафениба, в зависимости от их степени тяжести.
Пациенты с нарушением функции почек. Коррекция стартовой дозы у пациентов с легкой или средней степенью почечной недостаточности не требуется. Недостаточно данных для определения необходимости коррекции дозы у пациентов с тяжелой степенью почечной недостаточности.
Фотосенсибилизация. У пациентов, получавших вемурафениб, были зарегистрированы реакции фотосенсибилизации от легкой до тяжелой степени тяжести. Всем пациентам но время приема вемурафениба следует избегать пребывания на солнце. Пациентам, принимающим вемурафениб, во время пребывания на открытом воздухе следует носить одежду, защищающую от солнца, и использовать солнцезащитные средства с УФА- (УФ излучение диапазона А) и УФВ- (УФ излучение диапазона В) фильтрами и бальзам для губ (солнцезащитный фактор >30) для защиты от солнечных ожогов.
При реакциях фотосенсибилизации 2-й степени (непереносимость) и выше рекомендуется изменить дозу вемурафениба.
Влияние вемурафениба на другие ЛС. Вемурафениб может повышать экспозицию ЛС, которые преимущественно метаболизируются при участии изофермента CYP1A2, и снижать экспозицию ЛС, которые преимущественно метаболизируются при участии изофермента CYP3A4, в т.ч. пероральных контрацептивов.
Необходимость коррекции дозы ЛС, метаболизирующихся преимущественно при участии изоферментов CYP1А2 и CYP3A4, следует оценить до начала терапии вемурафенибом в зависимости от терапевтического индекса ЛС.
При одновременном применении вемурафениба и варфарина следует соблюдать осторожность и принимать во внимание MНO.
Влияние других ЛС на вемурафениб. На фармакокинетические параметры вемурафениба могут оказывать влияние ЛС, ингибирующие или влияющие на P-gp (например верапамил, кларитромицин, циклоспорин, ритонавир, хинидин, дронедарон, амиодарон, итраконазол, ранолазин).
По возможности следует избегать одновременного применения вемурафениба с мощными индукторами P-gp, глюкуронирования, изофермента CYP3A4 (например рифампицин, рифабутин, карбамазепин, фенитоин, зверобой продырявленный). С целью сохранения эффективности вемурафениба следует рассмотреть альтернативные варианты лечения ЛС с меньшим индуцирующим потенциалом.
Контрацепция у женщин и мужчин. Женщины и мужчины репродуктивного возраста должны использовать надежные методы контрацепции на протяжении всего курса приема вемурафениба и как минимум в течение 6 мес после прекращения приема. Вемурафениб может уменьшать эффективность гормональных контрацептивов, в связи с чем рекомендуется использовать альтернативный или дополнительный метод контрацепции.
Влияние на способность к вождению транспортных средств и работу с машинами и механизмами. Исследование влияния вемурафениба на способность к вождению транспортных средств и работу с машинами и механизмами не проводилось. Пациентов следует предупредить о возможном развитии головокружения, нарушений со стороны глаз и повышенной утомляемости, которые могут стать основанием для отказа от вождения.
Способ применения и дозы
Внутрь, независимо от приема пищи, рекомендуемая доза 960 мг 2 раза в день. Суточная доза — 1920 мг.